無機化學工業
出自 MBA智库百科(https://wiki.mbalib.com/)
無機化學工業(inorganic chemical industry)
目錄 |
什麼是無機化學工業[1]
無機化學工業是以天然資源和工業副產物為原料生產硫酸、硝酸、鹽酸、磷酸等無機酸,純鹼、燒鹼、合成氨、化肥以及無機鹽等化工產品的工業,包括硫酸工業、純鹼工業、氯鹼工業、合成氨工業、化肥工業和無機鹽工業。廣義上也包括無機非金屬材料和精細無機化學品,如陶瓷、無機顏料等的生產。無機化工是無機化學工業的簡稱。
無機化學工業的特點[2]
無機化工產品的原料主要是含硫、鈉、磷、鉀、鈣等元素的化學礦物和煤、石油、天然氣以及空氣、水等。此外,很多工業部門的副產物和廢物,也是無機化工的原料。例如鋼鐵工業中煉焦生產過程產生的焦爐煤氣,其中所笛的氨可用硫酸加以回收,製成硫酸銨,許多礦物冶煉的廢氣中含有的二氧化硫,可用來生產硫酸等。
與其他化工部門相比,無機化工的特點如下。
①在化學工業中是發展較早的部門,為化工中單元操作的形成和發展奠定了基礎。例如,合成氨生產過程需要在高壓、高溫以及有催化劑存在的條件下進行,它不僅促進了這些領域的技術發展,也推動了原料製造、氣體凈化和催化劑研製等方面的技術進步,而且對於催化技術在其他領域的發展起到了推動作用。
②主要產品多為用途廣泛的基本化工原料。除無機鹽品種繁多外,其他無機化工產品品種不多。例如,硫酸工業僅有硫酸、發煙硫酸、液體二氧化硫、液體三氧化硫等產品;氯鹼工業只有燒鹼、氯氣、鹽酸等產品;合成氨工業只有合成氨、尿素、硝酸、硝酸銨等產品。但硫酸、燒鹼、合成氨等主要產品都和國民經濟各部門有密切關係,其中硫酸有“化學工業之母”的稱號。
③與其他化工產品相比,無機化工產品的產量較大。例如,1984年世界硫酸產量為147.6Mt。1983—1984年世界化肥產量為130.2Mt(以有效成分計),純鹼、燒鹼的世界年產量也分別為30Mt以上。
無機化學工業的地位和作用[3]
無機化學工業的產品種類繁多,大宗的無機化工產品有硫酸、硝酸、鹽酸、純鹼、燒鹼、合成氨和氮、磷、鉀等化學肥料,它們在國民經濟中占有重要地位。其年產量在一定程度上反映一個國家的化學工業發展水平。
合成氨是最重要的化工產品之一,其產量居各種化工產品的首位。氨本身是重要的氮素肥料,其他氮素肥料也幾乎都是先合成氨,然後加工成各種肥料。農業上使用的氮肥,例如尿素、硝酸銨、碳酸氫銨、硫酸銨、氯化銨以及各種含氮復混肥料,都是以氨為原料。氨不僅可用來製造肥料,亦是重要的化工原料,基本化學工業中的硝酸、純鹼、含氮無機鹽,有機化學工業中的含氮中間體,製藥工業中的磺胺類藥物、維生素、氨基酸,化纖和塑料工業中的己內酰胺、己二胺、甲苯二異氰酸酯、人造絲、丙烯腈、酚醛樹脂等,也都直接或間接用氨作為原料。氨還應用於國防工業和尖端技術中。製造三硝基甲苯、三硝基苯酚、硝化甘油、硝化纖維等多種炸葯都消耗大量的氨。生產導彈、火箭的推進劑和氧化劑,同樣也離不開氨。
化肥工業對農業發展的重要性不言而喻。施用化肥,對於提高農作物產量和質量,其效果非常顯著,國內外公認化肥對農業增產的貢獻約占40%,故使用化肥已經成為發展農業的最重要措施之一。我國是一個擁有13億人口的大國,占世界總人口約1/5,但耕地面積卻只占世界耕地面積的7%。加上耕地逐年減少,人口逐年增加。在這種情況下,為了保證糧食的供給,提高糧食單產是最有效的措施之一。因此,化肥工業對於我國就顯得尤為重要。
硫酸是一種十分重要的基本化工原料,是產量最大的化工產品之一,工業生產已有二百七十年曆史,曾被譽為“工業之母”。它不僅是化學工業許多產品的原料,而且還廣泛應用於其他各個工業部門。在化肥生產中,某些磷肥、氮肥和多元複合肥料,都需用大量的硫酸。硫酸用於生產多種無機鹽、無機酸、有機酸、化學纖維、塑料、農藥、醫葯、顏料、染料及中間體等,它還是重要的化學試劑。在石油煉製、冶金、國防、能源、材料科學和空間科學中,硫酸用作洗滌劑,用於製造炸葯、提取鈾、生產鈦合金的原料二氧化鈦、合成高能燃料等。
氯鹼工業也是重要的基礎原料工業之一,氯鹼產品廣泛應用於國民經濟的各個部門,是人民生活衣、食、住、行不可缺少、與國民經濟息息相關的重要基本化工原料。在化學工業領域,以氯鹼工業產品為原料生產的產品現有千餘種,氯鹼產品廣泛應用於化學工業的各個領域。在醫葯工業領域,現有300種左右的藥品以氯鹼產品為原料,而醫用樹脂等也需要大量燒鹼、氯氣為原料。在輕工業領域,造紙行業用鹼量居各行業之首,其他如油脂化工、感光材料等的生產均使用燒鹼和氯氣。在紡織工業,各種紡織產品大多使用氯鹼產品。另外,在農業、建材、冶金、電力、電子、國防、石油、食品加工等各行業、各部門也均使用氯鹼產品。
無機化工產品中還有應用面廣、加工方法多樣、生產規模較小、品種為數眾多的無機鹽,即由金屬離子或銨離子與酸根陰離子組成的物質,例如硫酸鋁、硝酸鋅、碳酸鈣、硅酸鈉、高氯酸鉀、重鉻酸鉀、鉬酸銨等,約有1300多種。
除鹽類產品外,還有多種無機酸(磷酸、硼酸、鉻酸、砷酸、氫溴酸、氫氟酸等),氫氧化物(鉀、鈣、鎂、鋁、銅、鋇、鋰等的氫氧化物),元素化合物(氧化物、過氧化物、碳化物、氮化物、硫化物、氟化物、氯化物、溴化物、碘化物、氫化物、氰化物等),單質(鉀、鈉、磷、氟、溴、碘等)。
工業氣體(氧、氮、氫、氯、氨、氬、一氧化碳、二氧化碳、二氧化硫等)也屬於無機化工產品。
這些生產規模較小的產品也廣泛應用於國民經濟的各個部門,是不可或缺的化工產品。
重要的無機化學工業介紹[2]
合成氨(synthetic ammonia)是指由氮和氫在高溫、高壓和催化劑存在下直接合成的氨。目前,世界上的氨除了少量由焦爐氣中回收外。絕大部分是合成的。從動力學和熱力學角度考慮,合成氨需要有一個能使反應體系在儘可能低的溫度下達到平衡的、活潑而穩定的催化劑。哈伯等人在1905—1910年,進行了詳細的實驗,終於發現了對合成氨反應極為有效的含有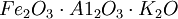 的所謂雙重促進鐵催化劑。該催化劑性能非常優異,現在使用的催化劑基本上與之相同。德國於1914年開始用這種催化劑大規模生產合成氨。
的所謂雙重促進鐵催化劑。該催化劑性能非常優異,現在使用的催化劑基本上與之相同。德國於1914年開始用這種催化劑大規模生產合成氨。
由於合成氣製備的原料和方法、合成氣的凈化、合成塔的設計等因素的不同,合成氨的生產工藝流程也不相同,但都包括以下三個步驟。
(1)原料氣的製備
氨是由3份氫氣和1份氮氣在一定條件下合成的,制取氫、氮的原料氣是合成氨生產的第一步。工業上普遍採用焦炭、無煙煤、天然氣和重油等含碳氫化合物的原料與水蒸氣、空氣作用的汽化方法制取。
(2)原料氣的凈化
採用煤和天然氣等原料制得的氫、氮原料氣中都含有硫化物、一氧化碳和二氧化碳,這些雜質都是氨合成催化劑的毒物。因此,氫、氮原料氣在合成氨之前,必須將這些雜質脫除。
(3)氨的合成
將凈化後的氫、氮混合氣壓縮至高壓,在鐵催化劑與高溫條件下合成為氨氣。合成氨的工藝流程如圖1所示。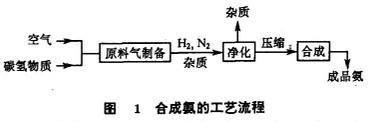
合成氨工業在國民經濟中的作用極為重要。氨的生產與加工,首先用做氮素化學肥料。液氨可直接做肥料施用,但因其易揮發,貯存、運輸與施肥需要一套特殊的設備,目前大多將氨加工成各種固體氮肥,如尿素、硝酸銨、硫酸銨、碳酸氫銨和氮化銨等。合成氨不僅對發展農業有著重要作用,而且也是重要的基本工業原料。如基本化學工業中的硝酸、純鹼和各種含氮無機鹽產品,有機化學工業中的各種中間體,製藥工業中磺胺類藥物和高分子工業中的聚酰胺纖維、氨基塑料、丁腈橡膠等,都需以氨或氨的衍生物為原料。而冶金、機械、冷凍、食品等行業中,也都要用到氨或氨的加工品。國防工業和現代尖端技術的發展,與氨的生產也有密切關係,各種含氮爆炸物,如三硝基甲苯、硝化甘油、苦味酸、硝化纖維和硝酸銨等的生產要消耗大量氨,而導彈、火箭的推進劑和氧化劑的生產也離不開合成氨。
哈伯的合成氨方法是20世紀初化學的一個重大成就,但該法要求反應在高溫高壓的苛刻條件下進行,人們希望在比較溫和的條件下生產氨。氮分子是一種公認的惰性分子,要在常溫常壓下使它活化並與氫分子反應生成氨,的確是很困難的。經過了將近一個世紀的研究,在20世紀90年代末,東京大學報道,通過分子氮配合物和分子氫配合物反應,在55℃產生了氨,產率達到55%。這是第一個在溫和條件下由氮氣合成氨氣的例子,其中的關鍵是催化劑的設計。
純鹼(sodium carbonate)又名蘇打或鹼灰,學名碳酸鈉,是一種重要的化工基本原料,是純鹼工業的主要產品。
1791年,法國人路布蘭以食鹽為原料加硫酸處理得到硫酸鈉,再以石灰石、煤粉燃燒製成純鹼,但該法主要的生產過程是在固相中進行,需要高溫,原料利用不充分,生產不連續,設備腐蝕嚴重,產品質量不純,價格貴,這促使人們研究新的方法。
1861年,比利時人索爾維獲得用鹽鹵與碳酸銨反應制得碳酸氫鈉的專利,接著他以飽和食鹽水、煉焦廠的粗氨水、石灰窯生產的石灰和二氧化碳為原料制出了純鹼,這種方法稱為氨鹼法。1862年實現了氨鹼法的工業化生產。由於這種方法生產的鹼質量純凈,故稱純鹼。
氨鹼法的化學過程如下。
①石灰石煅燒及石灰乳的製備: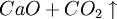
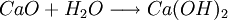
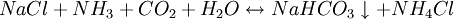
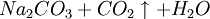
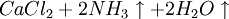
因此,氨鹼法是以二氧化碳、氨和氯化鈉水溶液反應生成碳酸氫鈉和氯化銨,將碳酸氫鈉結晶煅燒制得純鹼;氯化銨母液加石灰乳蒸餾回收迴圈使用。
氨鹼法具有原料易得、價格低廉、生產連續、產品純度高(含碳酸鈉98.5%以上),並能大規模工業生產等優點。所以自1861年投入生產後取代了路布蘭法,並一直被廣泛採用,至今已100多年。但此法有如下兩個主要缺點。
①氯化鈉的利用率低。氯化鈉的轉化率在理論上可以達到84%,實際生產中一般只能達到72%~76%。氯化鈉僅利用了部分的鈉離子,而24%~28%的鈉離子和全部的氯離子被以廢氣的形式排掉了。
②廢液的處理問題。每生產1t純鹼有10m3左右的廢液排出,難以處理。中國制鹼專家侯德榜對氨鹼法作了重大改革。1938年,侯德榜提出把索爾維制鹼工業與合成氨工業結合起來的想法。他在抗日戰爭期間,在十分艱苦的條件下進行了500多次實驗,分析了兩千多個樣品,終於在1943年發明瞭舉世聞名的聯合制鹼法,也稱侯氏制鹼法。
侯氏制鹼法的工藝過程根據化學平衡的基本原理,在除去碳酸氫鈉後的母液中加入磨細的氯化鈉固體,利用低溫時氯化銨的溶解度比氯化鈉小以及同離子效應,使氯化銨從母液中析出,母液中的氯化鈉可迴圈使用,析出的氯化銨可用於染料工業和制乾電池,也可做肥料等。
侯氏制鹼法與氨鹼法比較,有下列優點。
①原料利用率高,由於生產1t純鹼的同時,副產It氯化銨,所以食鹽的利用率可高達95%以上;
②不需要石灰石及焦炭,節約了原料、能量及運輸等的消耗,使純鹼和氯化銨的產品成本比其他生產方法有了大幅度下降;
③純鹼部分不需要石灰窯、蒸氨塔、化灰機等笨重設備,縮短了流程,建廠投資可省四分之一;
④無大量廢液、廢渣排出。
在侯氏制鹼法生產中,設備腐蝕是一個主要問題。腐蝕不但影響產品質量,而且關係著設備使用壽命,設備換修影響生產及經濟效益等各個方面,因此,侯氏制鹼法生產中的防腐措旋被視為純鹼工業中的重大技術問題之一。
硫酸是一種十分重要的基本化工原料,其用途十分廣泛,涉及到國民經濟各個工業部門和人民的物質生活,常以其產量高低作為衡量一個國家國民經濟發展水平的標誌之一。硫酸的最大用戶是化肥工業,產品的50%~60%用於磷肥、復肥生產,產品的20%以上用於冶金工業,如鋼鐵成品的酸洗及有色金屬的冶煉。在化學工業中,硫酸是生產硫酸鹽和其他酸的原料,也是塑料、人造纖維、油漆、製藥等生產中不可缺少的原料。在農藥、除草劑和殺鼠劑的生產中也都需要硫酸;在石油的精煉過程中使用大量硫酸作為洗滌劑,以除去石油產品中的不飽和烴和硫化物等雜質;在國防工業中,濃硫酸用於制取硝化甘油、硝化纖維和三硝基甲苯等炸葯;原子能工業、火箭工業等也要用到硫酸。
製造硫酸的歷史可以追溯到公元7世紀。中國煉丹家孤剛子所著<黃帝九鼎丹經訣》捲九中就介紹了蒸餾膽礬制取硫酸的方法:先除去膽礬中的水,再使之分解產生氣體,然後將此氣體溶於水中制得硫酸。8世紀,阿拉伯的煉金術士,將硝石與綠礬混在一起蒸餾,再將得到的氣體溶於水制得硫酸。17世紀前半葉,醫生和藥劑師把硫磺放進玻璃容器,並混入硝石加熱產生氣體,用水吸收制取硫酸。也有採用類似鐘罩的裝置,把硫磺放在裡面燃燒,並混入硝石以制取硫酸的。
隨著產業革命的成功,紡織工業的機械化,紗和布的漂白、染色對硫酸的需求加大,但當時只能在實驗室製備硫酸,遠遠不能滿足生產的要求。1746年,英國人羅巴克以鉛室代替玻璃容器,建造了鉛室法生產硫酸的工廠,成本大大降低,於是生產硫酸的工廠大量興建起來,初步解決了紡織工業對硫酸的需求。繼後,鉛室法的生產工藝雖不斷改進,但因流程複雜,收率較低,人們又試探用一種簡單的辦法生產硫酸。1831年英國人菲利浦用裝有鉑的瓷管加熱硫磺,在有充分的空氣與之作用下產生S03,使之溶於水中制得硫酸。1875年德國化學家麥塞爾用鉑做催化劑,並用氧氣代替空氣,用濃硫酸吸收S03制得發煙硫酸。此後,用這種接觸法生產硫酸的工廠興起了。到了20世紀30年代,有了更好的催化劑釩的化合物代替鉑,接觸法生產硫酸又得到進一步的發展。
目前硫酸的主要生產方法就是接觸法。制取硫酸的原料主要有硫化物礦、硫磺、硫酸鹽、含硫化氫的工業廢氣及冶煉煙氣等。接觸法的基本原理是應用固體催化劑,以空氣中的氧直接氧化二氧化硫。其生產過程主要包括以下幾個方面。
①原料破碎、篩分、配料或乾燥;
②硫鐵礦焙燒;
③爐氣凈化;
④二氧化硫催化氧化;
⑤爐氣乾燥和三氧化硫吸收;
⑥尾氣回收二氧化硫和污水處理。
硫酸生產過程排放的污染物,主要是含二氧化硫、三氧化硫和酸霧的尾氣,固體燒渣和酸泥,有毒酸性廢液、廢水等。這些物質直接排放,無疑會污染環境,必須加以處理和利用。







