无机化学工业
出自 MBA智库百科(https://wiki.mbalib.com/)
无机化学工业(inorganic chemical industry)
目录 |
什么是无机化学工业[1]
无机化学工业是以天然资源和工业副产物为原料生产硫酸、硝酸、盐酸、磷酸等无机酸,纯碱、烧碱、合成氨、化肥以及无机盐等化工产品的工业,包括硫酸工业、纯碱工业、氯碱工业、合成氨工业、化肥工业和无机盐工业。广义上也包括无机非金属材料和精细无机化学品,如陶瓷、无机颜料等的生产。无机化工是无机化学工业的简称。
无机化学工业的特点[2]
无机化工产品的原料主要是含硫、钠、磷、钾、钙等元素的化学矿物和煤、石油、天然气以及空气、水等。此外,很多工业部门的副产物和废物,也是无机化工的原料。例如钢铁工业中炼焦生产过程产生的焦炉煤气,其中所笛的氨可用硫酸加以回收,制成硫酸铵,许多矿物冶炼的废气中含有的二氧化硫,可用来生产硫酸等。
与其他化工部门相比,无机化工的特点如下。
①在化学工业中是发展较早的部门,为化工中单元操作的形成和发展奠定了基础。例如,合成氨生产过程需要在高压、高温以及有催化剂存在的条件下进行,它不仅促进了这些领域的技术发展,也推动了原料制造、气体净化和催化剂研制等方面的技术进步,而且对于催化技术在其他领域的发展起到了推动作用。
②主要产品多为用途广泛的基本化工原料。除无机盐品种繁多外,其他无机化工产品品种不多。例如,硫酸工业仅有硫酸、发烟硫酸、液体二氧化硫、液体三氧化硫等产品;氯碱工业只有烧碱、氯气、盐酸等产品;合成氨工业只有合成氨、尿素、硝酸、硝酸铵等产品。但硫酸、烧碱、合成氨等主要产品都和国民经济各部门有密切关系,其中硫酸有“化学工业之母”的称号。
③与其他化工产品相比,无机化工产品的产量较大。例如,1984年世界硫酸产量为147.6Mt。1983—1984年世界化肥产量为130.2Mt(以有效成分计),纯碱、烧碱的世界年产量也分别为30Mt以上。
无机化学工业的地位和作用[3]
无机化学工业的产品种类繁多,大宗的无机化工产品有硫酸、硝酸、盐酸、纯碱、烧碱、合成氨和氮、磷、钾等化学肥料,它们在国民经济中占有重要地位。其年产量在一定程度上反映一个国家的化学工业发展水平。
合成氨是最重要的化工产品之一,其产量居各种化工产品的首位。氨本身是重要的氮素肥料,其他氮素肥料也几乎都是先合成氨,然后加工成各种肥料。农业上使用的氮肥,例如尿素、硝酸铵、碳酸氢铵、硫酸铵、氯化铵以及各种含氮复混肥料,都是以氨为原料。氨不仅可用来制造肥料,亦是重要的化工原料,基本化学工业中的硝酸、纯碱、含氮无机盐,有机化学工业中的含氮中间体,制药工业中的磺胺类药物、维生素、氨基酸,化纤和塑料工业中的己内酰胺、己二胺、甲苯二异氰酸酯、人造丝、丙烯腈、酚醛树脂等,也都直接或间接用氨作为原料。氨还应用于国防工业和尖端技术中。制造三硝基甲苯、三硝基苯酚、硝化甘油、硝化纤维等多种炸药都消耗大量的氨。生产导弹、火箭的推进剂和氧化剂,同样也离不开氨。
化肥工业对农业发展的重要性不言而喻。施用化肥,对于提高农作物产量和质量,其效果非常显著,国内外公认化肥对农业增产的贡献约占40%,故使用化肥已经成为发展农业的最重要措施之一。我国是一个拥有13亿人口的大国,占世界总人口约1/5,但耕地面积却只占世界耕地面积的7%。加上耕地逐年减少,人口逐年增加。在这种情况下,为了保证粮食的供给,提高粮食单产是最有效的措施之一。因此,化肥工业对于我国就显得尤为重要。
硫酸是一种十分重要的基本化工原料,是产量最大的化工产品之一,工业生产已有二百七十年历史,曾被誉为“工业之母”。它不仅是化学工业许多产品的原料,而且还广泛应用于其他各个工业部门。在化肥生产中,某些磷肥、氮肥和多元复合肥料,都需用大量的硫酸。硫酸用于生产多种无机盐、无机酸、有机酸、化学纤维、塑料、农药、医药、颜料、染料及中间体等,它还是重要的化学试剂。在石油炼制、冶金、国防、能源、材料科学和空间科学中,硫酸用作洗涤剂,用于制造炸药、提取铀、生产钛合金的原料二氧化钛、合成高能燃料等。
氯碱工业也是重要的基础原料工业之一,氯碱产品广泛应用于国民经济的各个部门,是人民生活衣、食、住、行不可缺少、与国民经济息息相关的重要基本化工原料。在化学工业领域,以氯碱工业产品为原料生产的产品现有千余种,氯碱产品广泛应用于化学工业的各个领域。在医药工业领域,现有300种左右的药品以氯碱产品为原料,而医用树脂等也需要大量烧碱、氯气为原料。在轻工业领域,造纸行业用碱量居各行业之首,其他如油脂化工、感光材料等的生产均使用烧碱和氯气。在纺织工业,各种纺织产品大多使用氯碱产品。另外,在农业、建材、冶金、电力、电子、国防、石油、食品加工等各行业、各部门也均使用氯碱产品。
无机化工产品中还有应用面广、加工方法多样、生产规模较小、品种为数众多的无机盐,即由金属离子或铵离子与酸根阴离子组成的物质,例如硫酸铝、硝酸锌、碳酸钙、硅酸钠、高氯酸钾、重铬酸钾、钼酸铵等,约有1300多种。
除盐类产品外,还有多种无机酸(磷酸、硼酸、铬酸、砷酸、氢溴酸、氢氟酸等),氢氧化物(钾、钙、镁、铝、铜、钡、锂等的氢氧化物),元素化合物(氧化物、过氧化物、碳化物、氮化物、硫化物、氟化物、氯化物、溴化物、碘化物、氢化物、氰化物等),单质(钾、钠、磷、氟、溴、碘等)。
工业气体(氧、氮、氢、氯、氨、氩、一氧化碳、二氧化碳、二氧化硫等)也属于无机化工产品。
这些生产规模较小的产品也广泛应用于国民经济的各个部门,是不可或缺的化工产品。
重要的无机化学工业介绍[2]
合成氨(synthetic ammonia)是指由氮和氢在高温、高压和催化剂存在下直接合成的氨。目前,世界上的氨除了少量由焦炉气中回收外。绝大部分是合成的。从动力学和热力学角度考虑,合成氨需要有一个能使反应体系在尽可能低的温度下达到平衡的、活泼而稳定的催化剂。哈伯等人在1905—1910年,进行了详细的实验,终于发现了对合成氨反应极为有效的含有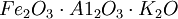 的所谓双重促进铁催化剂。该催化剂性能非常优异,现在使用的催化剂基本上与之相同。德国于1914年开始用这种催化剂大规模生产合成氨。
的所谓双重促进铁催化剂。该催化剂性能非常优异,现在使用的催化剂基本上与之相同。德国于1914年开始用这种催化剂大规模生产合成氨。
由于合成气制备的原料和方法、合成气的净化、合成塔的设计等因素的不同,合成氨的生产工艺流程也不相同,但都包括以下三个步骤。
(1)原料气的制备
氨是由3份氢气和1份氮气在一定条件下合成的,制取氢、氮的原料气是合成氨生产的第一步。工业上普遍采用焦炭、无烟煤、天然气和重油等含碳氢化合物的原料与水蒸气、空气作用的汽化方法制取。
(2)原料气的净化
采用煤和天然气等原料制得的氢、氮原料气中都含有硫化物、一氧化碳和二氧化碳,这些杂质都是氨合成催化剂的毒物。因此,氢、氮原料气在合成氨之前,必须将这些杂质脱除。
(3)氨的合成
将净化后的氢、氮混合气压缩至高压,在铁催化剂与高温条件下合成为氨气。合成氨的工艺流程如图1所示。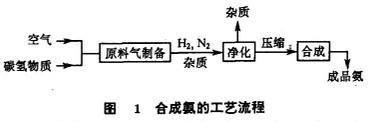
合成氨工业在国民经济中的作用极为重要。氨的生产与加工,首先用做氮素化学肥料。液氨可直接做肥料施用,但因其易挥发,贮存、运输与施肥需要一套特殊的设备,目前大多将氨加工成各种固体氮肥,如尿素、硝酸铵、硫酸铵、碳酸氢铵和氮化铵等。合成氨不仅对发展农业有着重要作用,而且也是重要的基本工业原料。如基本化学工业中的硝酸、纯碱和各种含氮无机盐产品,有机化学工业中的各种中间体,制药工业中磺胺类药物和高分子工业中的聚酰胺纤维、氨基塑料、丁腈橡胶等,都需以氨或氨的衍生物为原料。而冶金、机械、冷冻、食品等行业中,也都要用到氨或氨的加工品。国防工业和现代尖端技术的发展,与氨的生产也有密切关系,各种含氮爆炸物,如三硝基甲苯、硝化甘油、苦味酸、硝化纤维和硝酸铵等的生产要消耗大量氨,而导弹、火箭的推进剂和氧化剂的生产也离不开合成氨。
哈伯的合成氨方法是20世纪初化学的一个重大成就,但该法要求反应在高温高压的苛刻条件下进行,人们希望在比较温和的条件下生产氨。氮分子是一种公认的惰性分子,要在常温常压下使它活化并与氢分子反应生成氨,的确是很困难的。经过了将近一个世纪的研究,在20世纪90年代末,东京大学报道,通过分子氮配合物和分子氢配合物反应,在55℃产生了氨,产率达到55%。这是第一个在温和条件下由氮气合成氨气的例子,其中的关键是催化剂的设计。
纯碱(sodium carbonate)又名苏打或碱灰,学名碳酸钠,是一种重要的化工基本原料,是纯碱工业的主要产品。
1791年,法国人路布兰以食盐为原料加硫酸处理得到硫酸钠,再以石灰石、煤粉燃烧制成纯碱,但该法主要的生产过程是在固相中进行,需要高温,原料利用不充分,生产不连续,设备腐蚀严重,产品质量不纯,价格贵,这促使人们研究新的方法。
1861年,比利时人索尔维获得用盐卤与碳酸铵反应制得碳酸氢钠的专利,接着他以饱和食盐水、炼焦厂的粗氨水、石灰窑生产的石灰和二氧化碳为原料制出了纯碱,这种方法称为氨碱法。1862年实现了氨碱法的工业化生产。由于这种方法生产的碱质量纯净,故称纯碱。
氨碱法的化学过程如下。
①石灰石煅烧及石灰乳的制备: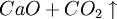
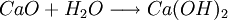
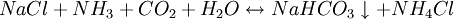
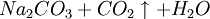
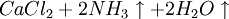
因此,氨碱法是以二氧化碳、氨和氯化钠水溶液反应生成碳酸氢钠和氯化铵,将碳酸氢钠结晶煅烧制得纯碱;氯化铵母液加石灰乳蒸馏回收循环使用。
氨碱法具有原料易得、价格低廉、生产连续、产品纯度高(含碳酸钠98.5%以上),并能大规模工业生产等优点。所以自1861年投入生产后取代了路布兰法,并一直被广泛采用,至今已100多年。但此法有如下两个主要缺点。
①氯化钠的利用率低。氯化钠的转化率在理论上可以达到84%,实际生产中一般只能达到72%~76%。氯化钠仅利用了部分的钠离子,而24%~28%的钠离子和全部的氯离子被以废气的形式排掉了。
②废液的处理问题。每生产1t纯碱有10m3左右的废液排出,难以处理。中国制碱专家侯德榜对氨碱法作了重大改革。1938年,侯德榜提出把索尔维制碱工业与合成氨工业结合起来的想法。他在抗日战争期间,在十分艰苦的条件下进行了500多次实验,分析了两千多个样品,终于在1943年发明了举世闻名的联合制碱法,也称侯氏制碱法。
侯氏制碱法的工艺过程根据化学平衡的基本原理,在除去碳酸氢钠后的母液中加入磨细的氯化钠固体,利用低温时氯化铵的溶解度比氯化钠小以及同离子效应,使氯化铵从母液中析出,母液中的氯化钠可循环使用,析出的氯化铵可用于染料工业和制干电池,也可做肥料等。
侯氏制碱法与氨碱法比较,有下列优点。
①原料利用率高,由于生产1t纯碱的同时,副产It氯化铵,所以食盐的利用率可高达95%以上;
②不需要石灰石及焦炭,节约了原料、能量及运输等的消耗,使纯碱和氯化铵的产品成本比其他生产方法有了大幅度下降;
③纯碱部分不需要石灰窑、蒸氨塔、化灰机等笨重设备,缩短了流程,建厂投资可省四分之一;
④无大量废液、废渣排出。
在侯氏制碱法生产中,设备腐蚀是一个主要问题。腐蚀不但影响产品质量,而且关系着设备使用寿命,设备换修影响生产及经济效益等各个方面,因此,侯氏制碱法生产中的防腐措旋被视为纯碱工业中的重大技术问题之一。
硫酸是一种十分重要的基本化工原料,其用途十分广泛,涉及到国民经济各个工业部门和人民的物质生活,常以其产量高低作为衡量一个国家国民经济发展水平的标志之一。硫酸的最大用户是化肥工业,产品的50%~60%用于磷肥、复肥生产,产品的20%以上用于冶金工业,如钢铁成品的酸洗及有色金属的冶炼。在化学工业中,硫酸是生产硫酸盐和其他酸的原料,也是塑料、人造纤维、油漆、制药等生产中不可缺少的原料。在农药、除草剂和杀鼠剂的生产中也都需要硫酸;在石油的精炼过程中使用大量硫酸作为洗涤剂,以除去石油产品中的不饱和烃和硫化物等杂质;在国防工业中,浓硫酸用于制取硝化甘油、硝化纤维和三硝基甲苯等炸药;原子能工业、火箭工业等也要用到硫酸。
制造硫酸的历史可以追溯到公元7世纪。中国炼丹家孤刚子所著<黄帝九鼎丹经诀》卷九中就介绍了蒸馏胆矾制取硫酸的方法:先除去胆矾中的水,再使之分解产生气体,然后将此气体溶于水中制得硫酸。8世纪,阿拉伯的炼金术士,将硝石与绿矾混在一起蒸馏,再将得到的气体溶于水制得硫酸。17世纪前半叶,医生和药剂师把硫磺放进玻璃容器,并混入硝石加热产生气体,用水吸收制取硫酸。也有采用类似钟罩的装置,把硫磺放在里面燃烧,并混入硝石以制取硫酸的。
随着产业革命的成功,纺织工业的机械化,纱和布的漂白、染色对硫酸的需求加大,但当时只能在实验室制备硫酸,远远不能满足生产的要求。1746年,英国人罗巴克以铅室代替玻璃容器,建造了铅室法生产硫酸的工厂,成本大大降低,于是生产硫酸的工厂大量兴建起来,初步解决了纺织工业对硫酸的需求。继后,铅室法的生产工艺虽不断改进,但因流程复杂,收率较低,人们又试探用一种简单的办法生产硫酸。1831年英国人菲利浦用装有铂的瓷管加热硫磺,在有充分的空气与之作用下产生S03,使之溶于水中制得硫酸。1875年德国化学家麦塞尔用铂做催化剂,并用氧气代替空气,用浓硫酸吸收S03制得发烟硫酸。此后,用这种接触法生产硫酸的工厂兴起了。到了20世纪30年代,有了更好的催化剂钒的化合物代替铂,接触法生产硫酸又得到进一步的发展。
目前硫酸的主要生产方法就是接触法。制取硫酸的原料主要有硫化物矿、硫磺、硫酸盐、含硫化氢的工业废气及冶炼烟气等。接触法的基本原理是应用固体催化剂,以空气中的氧直接氧化二氧化硫。其生产过程主要包括以下几个方面。
①原料破碎、筛分、配料或干燥;
②硫铁矿焙烧;
③炉气净化;
④二氧化硫催化氧化;
⑤炉气干燥和三氧化硫吸收;
⑥尾气回收二氧化硫和污水处理。
硫酸生产过程排放的污染物,主要是含二氧化硫、三氧化硫和酸雾的尾气,固体烧渣和酸泥,有毒酸性废液、废水等。这些物质直接排放,无疑会污染环境,必须加以处理和利用。







