金屬
出自 MBA智库百科(https://wiki.mbalib.com/)
金屬(Metal)
目錄 |
金屬是一種具有光澤(即對可見光強烈反射)、富有延展性、容易導電、導熱等性質的物質。金屬的上述特質都跟金屬晶體內含有自由電子有關。在自然界中,絕大多數金屬以化合態存在,少數金屬例如金、鉑、銀、鉍以游離態存在。金屬礦物多數是氧化物及硫化物。其他存在形式有氯化物、硫酸鹽、碳酸鹽及硅酸鹽。金屬之間的連結是金屬鍵,因此隨意更換位置都可再重新建立連結,這也是金屬延展性良好的原因。金屬元素在化合物中通常只顯正價。相對分子質量較大的被稱為重金屬。
金屬的分類[1]
金屬通常可分為黑色金屬和有色金屬兩大類:
1.黑色金屬。包括鐵、錳和鉻以及它們的合金,主要是鐵碳合金(鋼鐵)。
2.有色金屬。是指除去鐵、鉻、錳之外的所有金屬。有色金屬大致上按其密度、價格、在地殼中的儲量和分佈情況、被人們發現以及使用的早晚等分為五大類:
(1)輕有色金屬:一般指密度在 4.5g/cm3以下的有色金屬,如:鋁、鎂、鈉、鉀、鈣、鍶、鋇。
(2)重有色金屬:一般指密度在 4.5g/cm3以上的有色金屬,其中有銅、鎳、鉛、鋅、鈷、錫、汞、錫等。
(3)貴金屬:這類金屬包括金、銀和鉑族元素(鉑、銥、俄、釕、鈀、銠),由於它們對氧和其它試劑的穩定性,而且在地殼中含量少,開采和提取比較困難故價格比一般金屬貴,因而得名貴金屬。它們的特點是密度大(10.4~22.48 g/cm3);熔點高(1189—3273K);化學性質穩定。
(4)準金屬:一般指硅、銘、硒、砷、硼,其物理化學性質介於金屬與非金屬之間,如脆,是電和熱的不良導體。
(5)希有金屬:通常是指在自然界中含量很少,分佈稀散、發現較晚,難以從原料中提取的或在工業上製備及應用較晚的金屬。這類金屬包括:鋰、銣、銫、鈹、鎢、鉬、鉭、鈮、鈦、鉿、釩、錸、鎵、銦、鉈、鍺、希土元素及人造超鈾元素等。
金屬在自然界的存在[1]
1.游離態:Au, Ag, Bi, Re (稀少)
2.游離態及化合態:較活潑金屬:如鐵,有單質、氧化物
3.化合態:活潑金屬
(1)鹵化物:ⅠA.ⅡA
(2)難溶鹽礦石:ⅡA的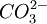 、
、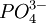 、
、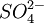 、硅鋁酸鹽
、硅鋁酸鹽
(3)氧化物及硫化物:過渡金屬
金屬的性質[1]
1.金屬光澤
由於金屬原子以最緊密堆積狀態排列,內部存在自由電子,所以當光線投射到它的錶面上時,自由電子吸收所有頻率的光,然後很快放出各種頻率的光,這就使絕大多數金屬呈現鋼灰色以至銀白色光澤。此外金顯黃色,銅顯赤紅色,鉍為談紅色,銫為淡黃色以及鉛是灰藍色,這是因為它們較易吸收某一些頻率的光之故。金屬光澤只有在整塊時才能表現出來,在粉末狀時,一般金屬都呈暗灰色或黑色。這是因為在粉末狀時,金屬晶面取向雜亂,晶格排列得不規則,吸收可見光後輻射不出去,所以為黑色。
許多金屬在光的照射下能放出電子。有一些能在短波輻射照射下放出電氣這種現象稱為光電效應。另一些在加熱到高溫時能放出電子,這種現象稱為熱電現象。
2.金屬的導電性和導熱性
根據金屬鍵的概念,所有金屬中都有自由電子,在沒有外加電場作用時,自由電子沒有一定運動方向,因此沒有定向電流產生。當金屬導線接到電源的正、負兩極時,有了電勢差、自由電子便沿著導線由負極移向正極,形成電流。這就顯示出導電性。這與電解質的水溶液或熔融鹽的導電原因是不同的,離子導電在兩極上會發生化學反應。
3.金屬的延展性
金屬的延性,可以抽成絲。如最細的白金直徑不過1/5000mm。
金屬的展性,可以壓成薄片。如最薄的金箔,只有1/10000mm厚。
4.金屬的密度
鋰、鈉、鉀比水輕,大多數金屬密度較大。
5.金屬的硬度
金屬的硬度一般較低大,但它們之間有很大的差別較大。有的堅硬如鉻、鎢等。有些軟可用小刀切割如鈉、鉀。
6.金屬的熔點
金屬的熔點一般較高,但高低差別較大。最難熔的是鎢,最易熔的是汞,銫和鎵。汞在常溫下是液體,銫和鎵在手上受熱就能熔化。
(一)金屬與非金屬反應
位於金屬活動順序表前面的一些金屬很與氧化合形成氧化物,鈉、鉀的氧化很快,銣、銫會發生自燃。位於金屬活動順序表後面的一些金屬,如銅、汞等必須在加熱情況下才能與氧化合,而銀、金即使在熾熱的情況下也很難與氧等非金屬化合。如鋁、鉻形成緻密的氧化膜,防止金屬繼續被氧化,即鈍化。在空氣中鐵錶面生成的氧化物結構疏鬆,因此,鐵在空氣中易被腐蝕。
(二)金屬與水、酸的反應
在常溫下純水的[H + ] = 10 − 7mol·L − 1,其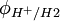 =-0.41V。因此,φ0<-0.41V的金屬都可能與水反應。
=-0.41V。因此,φ0<-0.41V的金屬都可能與水反應。
鈉、鉀與水劇烈反應。鈣與水的作用比較緩和,鎂只能與沸水起反應,鐵則須在熾熱的狀態下與水蒸氣發生反應。如鎂等與水反應生成的氫氧化物不溶於水,覆蓋在金屬錶面,在常溫時使反應難於繼續進行。
一般φ0<0 的金屬都可以與非氧化性酸反應放出氫氣。有一些金屬“鈍化”。如鉛與硫酸反應生成難溶物。φ0>0 的金屬一般不容易被酸中的氫離子氧化,只能被氧化性的酸氧化,或在氧化劑的存在下,與非氧化性酸反應。如銅不和稀鹽酸反應,而能與硝酸反應。
(三)金屬與鹼反應
金屬除了少數顯兩性以外,一般都不與鹼起作用。鋅、鋁與強鹼反應,生成氫和鋅酸鹽或鋁酸鹽,反應如下:
Zn+2NaOH+2H2O===Na2[Zn(OH)4] + H2
2Al+2NaOH+6H2O===2Na[Al(OH)4] + 3H2
鈹、鎵、銦、錫等也能與強鹼反應。
(四)金屬與配位劑的作用
由於配合物的形成,改變了金屬的φ0值,從而影響元素的性質。如銅不能從水中置換出氫氣,但在適當配位劑存在時,反應就能夠進行:
2Cu+2H2O + 4CN − ===2[Cu(CN)2] − + 2OH − + H2
如有氧參加,這類反應更易進行。
4M+2H2O + 8CN − + O2 = 4[M(CN)2] − + 4OH − (M=Cu,Ag,Au)
這個反應是從礦石中提煉銀和金的基本反應。王水與金、鉑的反應都與形成配合物有關。
在這些反應中,金屬都是還原劑,但是也有例外。例如,除了鹵素以外,金的電子親和勢比任何其它元素都要高,故可以制得含Au − 的化合物,CsAu是一個含Au − 的離子化合物。







